Washington – Se está anunciando el retiro voluntario de dos marcas de gotas para los ojos debido a los riesgos de contaminación que podrían provocar problemas de visión y lesiones graves.
El anuncio llega luego de que el mes pasado también se recomendara dejar de usar las gotas para los ojos EzriCare Artificial Tears, sin embargo no hay indicios de que los últimos retiros estén relacionados con esos productos.
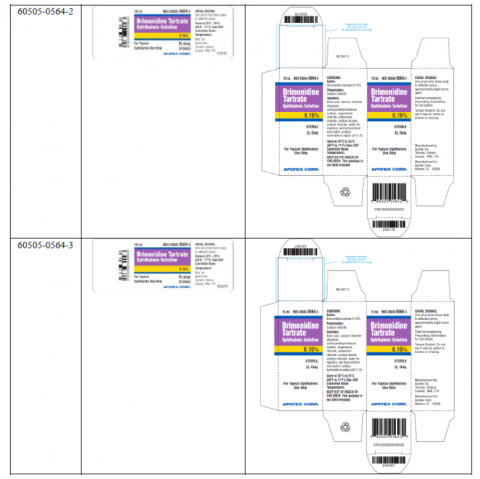
La Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) publicó el aviso de retiro por Apotex el pasado 2 de marzo, luego de que la compañía dijera que retirará voluntariamente varios lotes de sus gotas para los ojos del mercado.
Apotex dijo que está retirando seis lotes de gotas para los ojos con receta que se usan para tratar una forma de glaucoma. La compañía dijo que lanzó el retiro después de encontrar grietas en algunas tapas de botellas. «Existe la posibilidad de que la tapa rota pueda afectar la esterilidad y, de ser así, la posibilidad de eventos adversos», señala la compañía.
Las gotas se distribuyen como solución oftálmica de tartrato de brimonidina 0,15% y se vendieron a nivel nacional entre el 05 de abril de 2022 y el 22 de febrero de 2023.
Un día después (el 3 de marzo) también se emitió un anuncio por parte de Pharmedica con el retiro de dos lotes de gotas de MSM al 15% debido a la falta de esterilidad. «El uso de gotas para los ojos contaminadas puede provocar el riesgo de infecciones oculares que podrían provocar ceguera», según el anuncio.
Las gotas de venta libre, están diseñadas para tratar la irritación ocular. La compañía dijo que los consumidores deberían dejar de usar las gotas y devolverlas al lugar donde las compró.
El retiro afecta a casi 2.900 botellas, distribuidas en todo el mundo por Purely Soothing LLC a través de comercio electrónico en línea y ferias comerciales, según señaló la compañía.

Los pacientes que hayan recibido los lotes identificados o tengan preguntas sobre este retiro deben comunicarse con su farmacia. Deben comunicarse de inmediato con su proveedor de atención médica para recibir asesoramiento médico y devolver los lotes identificados.
Ambas compañías dijeron que los retiros se realizaron en consulta con la FDA.








